
Nitơ hóa trị mấy? Tính chất và ứng dụng của nitơ
Nitơ là một trong những nguyên tố hóa học có vai trò quan trọng với cơ thể con người và sự sống trên trái đất. Vậy nitơ là gì? Nitơ hóa trị mấy, tính chất và ứng dụng như thế nào? VietChem sẽ phân tích chi tiết trong bài viết bên dưới đây.
1. Nitơ là gì?
Nitơ được viết theo công thức hóa học là N2. Đây là thành phần chiếm tỉ lệ lớn của khí quyển và đóng vai trò quan trọng với cơ thể sống. Nitơ tham gia vào quá trình bảo vệ trái đất khỏi bức xạ mặt trời.
Hiện nay, Nitơ tồn tại ở hai dạng là Nitơ lỏng và Nitơ khí. Trong đó, Nitơ lỏng có nhiều đặc tính hữu ích nên được ứng dụng rộng rãi.
Nitơ tồn tại ở dạng tự do và hợp chất trong tự nhiên. Ở dạng tự do, chúng chiếm tỷ lệ khá cao trong thể tích không khí. Khi tồn tại ở dạng hợp chất, Nitơ là thành phần của nhiều hợp chất như axit nucleic, protein…
Công thức hóa học của Nitơ là N2
2. Nitơ hóa trị mấy
Không giống như một số chất khí khác chỉ có một hóa trị duy nhất. Nitơ có 3 hóa trị khác nhau. Bao gồm: Hóa trị II, hóa trị III và hóa trị IV.
4. Tính chất của Nitơ
4.1. Tính chất vật lý
Nitơ là chất khí nhẹ hơn không khí, không mùi, không vị và không có màu. Chúng ít tan trong nước và hóa rắn ở nhiệt độ rất thấp. Nhiệt độ hóa lỏng của Nitơ vào khoảng -1960C.
Một số thông tin khác về Nitơ:
- Ký hiệu nguyên tử: N
- Số hiệu nguyên tử: Số hiệu 7 thuộc nhóm VA
- Số oxh của N2: -3, 0, +1, +2, +3, +4, +5
- Nhiệt độ sôi: 77,36K
- Nhiệt độ nóng chảy: 63,15K

Nitơ là chất khí và nhẹ hơn không khí
4.2. Tính chất hóa học
Ngoài việc tìm hiểu về Nitơ hóa trị mấy, nắm rõ tính chất hóa học của chất khí này sẽ giúp ích rất nhiều. Theo đó, Nitơ nhiều số oxi hóa khác nhau bao gồm cả 0. Vì thế, chúng vừa có tính khử và tính oxi hóa. Nitơ hoạt động nhiều hơn ở nhiệt độ cao nhưng trơ về mặt hóa học với điều kiện nhiệt độ thường.
Tính khử của Nitơ
- Nitơ phản ứng cùng với những nguyên tố có độ âm điện lớn hơn do có tính khử. Nhất là khi ở nhiệt độ cao hơn 30000C. Khi đó kết thúc phản ứng sẽ thu được Nitơ monoxit.
Phương trình phản ứng: N2 + O2 → 2NO (không màu)
Trong đó, N2 có hóa trị 0, N trong NO có hóa trị +2.
- Trong điều kiện nhiệt độ thường, Nitơ monoxit sẽ tác dụng với oxi trong không khí. Kết quả tạo thành Nitơ đioxit có màu nâu đỏ.
Phương trình phản ứng: 2NO + O2 → 2NO2
Trong đó, N trong NO2 có hóa trị +4.
Tính oxi hóa của Nitơ
Nitơ tác dụng với nguyên tố có độ âm điện nhỏ hơn do đặc tính oxi hóa. Bao gồm, phản ứng với kim loại và hidro:
- Tác dụng với kim loại
Ở điều kiện thường: Nitơ chỉ tác dụng với duy nhất Li để tạo thành Liti Nitrua.
Phương trình: 6Li + N2 → 2Li3N
Ở điều kiện nhiệt độ cao, Nitơ có thể tác dụng với nhiều kim loại khác nhau tạo thành Nitrua. Tuy nhiên, Nitrua dễ bị thủy phân tạo thành NH3.
Phương trình: 3Mg + N2 → Mg3N2
- Tác dụng với hidro
Nitơ phản ứng với hidro ở nhiệt độ, áp suất cao kèm chất xúc tác. Kết thúc phản ứng tạo thành amoniac.
Phương trình phản ứng: N2 + 3H2 ↔ 2NH3
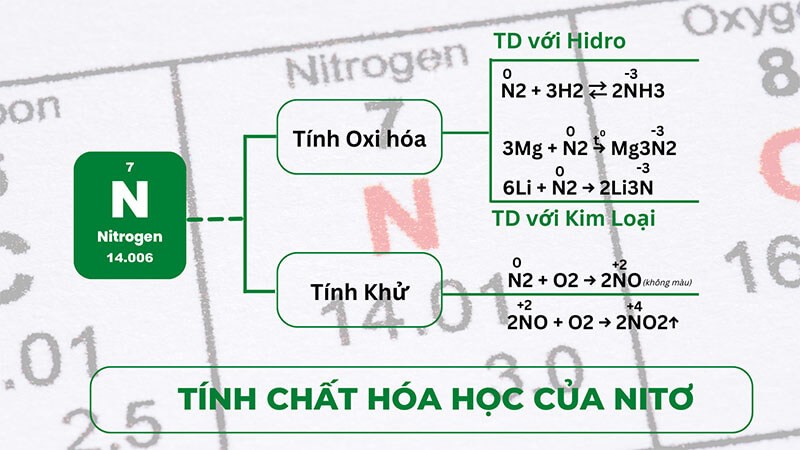
Tính chất hóa học của Nitơ
5. Ứng dụng của Nitơ
Tính ứng dụng của Nitơ cùng Nitơ hóa trị mấy được tìm hiểu khá nhiều. Hiện nay, Nitơ dạng khí được ứng dụng phổ biến trong đời sống. Bao gồm:
- Trong nghiên cứu giáo dục: Phân tích mẫu và dùng để nghiên cứu các hợp chất hóa học.
- Trong chế biến sinh học và vận chuyển thực phẩm: Nitơ có vai trò trong việc làm lạnh để đảm bảo an toàn trong khâu bảo quản thực phẩm.
- Trong y học: Bảo vệ các bộ phận của cơ thể không bị phân hủy. Nhất là bảo quản trứng và tinh trùng khi vận chuyển.
- Trong chế tác kim loại và luyện kim: Thành phần trong sản xuất thép không gỉ, linh kiện điện tử, luyện kim…
- Trong sản xuất máy bay và lốp ô tô: Bơm lốp ô tô và bơm lốp máy bay.
- Trong chế biến kim loại và hàn ống: Làm sạch đường ống, giúp hạn chế tối đa những hư hại trong quá trình sử dụng thiết bị.
- Trong bảo quản thực phẩm: Nitơ có tính trơ nên có thể ngăn chặn sự oxi hóa tốt. Vì thế, sử dụng Nitơ để bảo quản thực phẩm là một trong những biện pháp hữu ích.
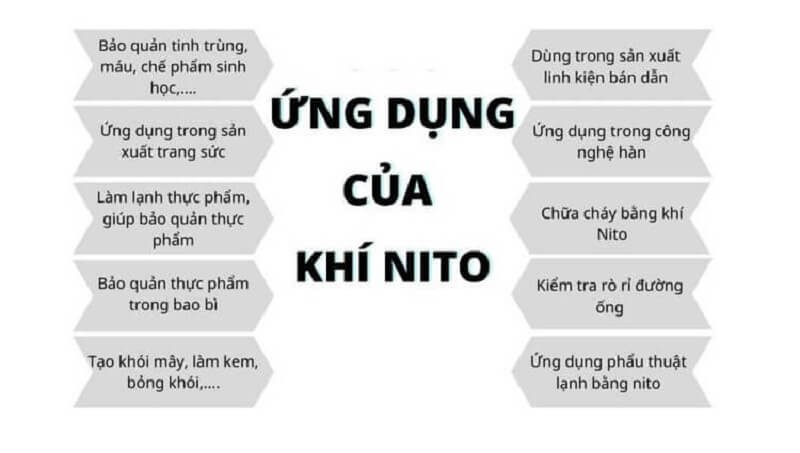
Nitơ có nhiều ứng dụng trong đời sống
6. Cách điều chế Nitơ
Trong phòng thí nghiệm
Sử dụng dung dịch muối amoni nitrit bão hòa để điều chế Nitơ là phương pháp phổ biến trong phòng thí nghiệm.
Trong công nghiệp
Điều chế Nitơ trong công nghiệp bằng cách chưng cất phân đoạn không khí lỏng. Nitơ thu được ở nhiệt độ -1960C và lưu trữ trong các bình thép nén với áp suất 125at.
Nitơ hóa trị mấy đã được chia sẻ chi tiết trong bài viết trên. Hy vọng những chia sẻ của VietChem sẽ giúp giải đáp mọi thắc mắc của các bạn. Nếu cần tìm hiểu nhiều hơn, hãy liên hệ với chúng tôi theo số hotline để được hỗ trợ.
Link nội dung: https://ausp.edu.vn/nito-hoa-tri-may-tinh-chat-va-ung-dung-cua-nito-a14386.html