
Khái niệm về cân bằng hóa học - Hóa 11 mới
1. Các khái niệm về cân bằng hóa học
Khái niệm phản ứng hóa học: Là quá trình biến đổi các chất đầu thành sản phẩm. Tuy nhiên, có nhiều phản ứng, các chất sản phẩm sinh ra lại có thể phản ứng với nhau tạo thành các chất ban đầu.
1.1 Phản ứng một chiều
Xét một phản ứng đốt cháy khí methane trong khí oxygen:
CH4 + 2O2 CO2 + 2H2O
Khi đốt cháy khí methane, sẽ thu được sản phẩm bao gồm khí carbon dioxide và hơi nước. Trong điều kiện này, các chất sản phẩm không phản ứng được với nhau để tạo thành chất ban đầu. Phản ứng có chiều phản ứng như trên được gọi là phản ứng một chiều.
Phương trình hoá học của phản ứng một chiều sẽ được biểu diễn bằng một mũi tên một chiều chỉ chiều phản ứng.
Ví dụ: NaOH + HCI → NaCl + H₂O
1.2 Phản ứng thuận nghịch
Hai thí nghiệm sau đều được thực hiện ở cùng một điều kiện (bình kín dung tích 10L, nhiệt độ 445°C):
Thí nghiệm 1: Cho 1 mol H₂ và 1 mol I₂, vào bình kín. Kết quả thí nghiệm đã cho thấy dù thời gian phản ứng có kéo dài bao lâu thì trong bình vẫn sẽ chỉ tạo ra 1,6 mol HI; còn dư 0,2 mol H₂ và 0,2 mol I₂.
Thí nghiệm 2: Cho 2 mol HI vào bình kín. Kết quả thí nghiệm cũng cho thấy dù thời gian của phản ứng kéo dài trong bao lâu thì trong bình cũng vẫn chỉ tạo ra 0,2 mol H₂ và 0,2 mol I₂ và còn dư 1,6 mol HI.
Thực hiện những yêu cầu sau:
a) Viết phương trình hoá học của các phản ứng đã xảy ra trong thí nghiệm 1 và thí nghiệm 2 b) Trong cả hai thí nghiệm ở trên, cho dù thời gian của phản ứng kéo dài thêm bao lâu thì các chất ban đầu đều sẽ còn lại sau khi phản ứng. Giải thích.
Ở nhiệt độ 445 °C, trong bình chứa hỗn hợp H, và I, xảy ra đồng thời hai phản ứng:
H₂ (g) + I₂ (g) → 2HI (g) (1)
2HI (g) → H₂ (g) + I₂ (g) (2)
Ở thí nghiệm 1, khi H₂, tác dụng với I₂, tạo thành HI, đồng thời HI lại phân huỷ để tạo thành I₂, và H₂ nên dù thời gian kéo dài bao lâu, phản ứng vẫn không thể xảy ra hoàn toàn.
Phản ứng giữa H₂ và I₂, trong điều kiện trên được gọi là loại phản ứng thuận nghịch và được biểu diễn bằng phương trình hoá học sau:
H₂(g) + I₂(g) ⇌ 2HI(g)
Tương tự, ở thí nghiệm 2 cũng đã xảy ra phản ứng thuận nghịch:
2HI(g) ⇌ H₂(g) + I₂(g)
Phản ứng thuận nghịch được định nghĩa là phản ứng xảy ra theo hai chiều ngược nhau ở trong cùng một điều kiện.
Phương trình hoá học của phản ứng thuận nghịch sẽ được biểu diễn bằng dấu hai nửa mũi tên ngược chiều nhau. Chiều phản ứng từ trái sang phải là chiều phản ứng thuận, còn chiều phản ứng từ phải sang trái sẽ là chiều phản ứng nghịch.
Trong thực tế, các phản ứng thuận nghịch thường xảy ra không hoàn toàn bởi vì khi ở trong cùng một điều kiện, các chất sẽ phản ứng tác dụng với nhau để tạo thành các chất sản phẩm sau phản ứng (phản ứng thuận) đồng thời các chất sản phẩm lại tác dụng cùng với nhau để tạo thành các chất ban đầu (phản ứng nghịch)
Đăng ký ngay khóa học DUO 11 để được thầy cô lên lộ trình ôn thi tốt nghiệp ngay từ bây giờ nhé!

1.3 Trạng thái cân bằng
Xét phản ứng thuận nghịch: H₂(g) + I₂(g) ⇌ 2HI(g)
Số liệu về sự thay đổi số mol các chất trong bình phản ứng ở thí nghiệm 1 được trình bày trong bảng dưới đây:
Bảng số mol của các chất có trong bình phản ứng trong thí nghiệm 1 thay đổi theo đơn vị thời gian
Thời gian (s) to t1 t2 t3 t4 t5 ... tThực hiện các yêu cầu:
a) Hãy vẽ đồ thị biểu diễn được sự thay đổi về số mol của các chất theo đơn vị thời gian
b) Từ đồ thị, hãy đưa ra những nhận xét về sự thay đổi về số mol của các chất theo khoảng thời gian.
c) Viết ra biểu thức về định luật tác dụng khối lượng đối với phản ứng thuận và phản ứng nghịch, từ đó hãy dự đoán về những sự thay đổi tốc độ trong mỗi phản ứng theo đơn vị thời gian (biết rằng các phản ứng này đều là những phản ứng đơn giản)
d) Bắt đầu từ thời điểm t nào thì số mol của các chất ở trong hệ phản ứng sẽ không bị thay đổi nữa?
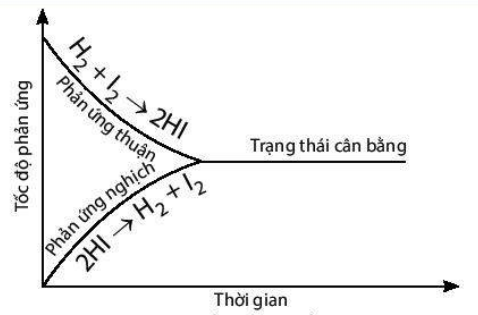
Trong thí nghiệm trên, lúc đầu phản ứng thuận có tốc độ lớn hơn phản ứng nghịch và ưu tiên tạo ra hydrogen iodide. Theo thời gian, tốc độ phản ứng thuận giảm dần, tốc độ phản ứng nghịch tăng dần đến khi tốc độ hai phản ứng bằng nhau (Hình trên). Tại thời điểm này, số mol của các chất hydrogen, iodine, hydrogen iodide sẽ không thay đổi nữa. Đây chính là thời điểm để phản ứng thuận nghịch đạt được tới trạng thái cân bằng.
Khái niệm: Trạng thái cân bằng của một phản ứng thuận nghịch chính là trạng thái mà tại đó tốc độ của phản ứng thuận bằng với tốc độ phản ứng nghịch.
Cân bằng hoá học là một cân bằng động, các chất tham gia sẽ xảy ra phản ứng liên tục với nhau để tạo thành các chất sản phẩm và những chất sản phẩm cũng lại liên tục phản ứng với nhau để tạo thành được những chất ban đầu nhưng với một tốc độ bằng nhau nên ở trạng thái cân bằng, nồng độ các chất sẽ không bị thay đổi.
2. Ý nghĩa biểu thức hằng số cân bằng
2.1 Biểu thức hằng số cân bằng
Xét phản ứng thuận nghịch: H₂(g) + I₂(g) ⇌ 2HI(g). Thực hiện phản ứng trên ở trong bình kín, ở nhiệt độ 445 °C với các nồng độ ban đầu khác nhau. Số liệu về nồng độ của các chất ở thời điểm ban đầu và ở trạng thái cân bằng trong các thí nghiệm được trình bày trong bảng dưới đây.
Nồng độ các chất ở thời điểm ban đầu (mol/L)Nồng độ các chất ở trạng thái cân bằng (mol/L)
H2 I2 HI H2 I2 HIThí nghiệm 1
0.1 0.1 0 0,02000 0,02000 0,02000Thí nghiệm 2
0.1 0.2 0 0,00532 0,10532 0,18936Thí nghiệm 3
0,3 0,1 0 0,202900,00290
0,19420Bảng nồng độ các chất của phản ứng H₂(g) + I₂(g) ⇌ 2HI(g) ở thời điểm ban đầu và ở trạng thái cân bằng
Tính giá trị ở mỗi thí nghiệm và nhận xét kết quả thu được.
được gọi là biểu thức hằng số cân bằng của phản ứng thuận nghịch:
H₂(g) + I₂(g) ⇌ 2HI(g)
Xét phản ứng thuận nghịch tổng quát: aA+bB ⇌ cC+dD:
Ở trạng thái cân bằng, hằng số cân bằng (KC) của phản ứng sẽ được xác định theo biểu thức dưới đây:
Trong đó: Ký hiệu [A], [B], [C], [D] là biểu thị cho nồng độ mol của các chất A, B, C, D khi ở trạng thái cân bằng; a, b, c, d là biểu thị cho hệ số tỉ lượng của các chất trong phương trình hoá học khi tham gia phản ứng.
Thực nghiệm cho thấy hằng số cân bằng Kc của một phản ứng thuận nghịch chỉ phụ thuộc nhiệt độ và bản chất của phản ứng. Đối với những phản ứng khi có chất rắn tham gia, sẽ không biểu diễn nồng độ của chất rắn ở trong biểu thức hằng số cân bằng. Ví dụ:
C(s)+ CO₂(g) ⇌ 2CO(g)
2.2 Ý nghĩa biểu thức hằng số cân bằng
Hằng số cân bằng Kc sẽ phụ thuộc vào bản chất của phản ứng và nhiệt độ của phản ứng.
Biểu thức xác định hằng số cân bằng cho thấy: KC càng lớn thì phản ứng thuận càng chiếm ưu thế hơn và ngược lại, KC càng nhỏ thì phản ứng nghịch càng chiếm ưu thế hơn.

3. Các yếu tố ảnh hưởng đến cân bằng hóa học
3.1 Yếu tố nhiệt độ
Thí nghiệm 1: Ảnh hưởng của nhiệt độ tới sự chuyển dịch cân bằng của phản ứng:
2NO2(g) ⇌ N2O4(g)
(màu nâu đỏ) (không màu)
Chuẩn bị: 3 ống nghiệm thủy tinh chứa khí NO2, nút kín bịt ống nghiệm có màu giống nhau, cốc nước đá và cốc nước nóng.
Tiến hành:
- Ống nghiệm (1) để so sánh.
- Ngâm ống nghiệm thứ (2) vào trong cốc nước đá trong khoảng thời gian 1 - 2 phút.
- Ngâm ống nghiệm thứ (3) vào trong cốc nước nóng trong khoảng thời gian 1 - 2 phút.
Lưu ý: NO2 là một chất khí độc, cần nút kín khi thực hành thí nghiệm.
Thí nghiệm 2. Ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng của phản ứng:
CH3COONa + H2O ⇌ CH3COOH + NaOH
Chuẩn bị: dung dịch CH3COONa 0,5 M, phenolphthalein; cốc nước nóng, cốc nước
nước đá, 3 ống nghiệm.
Tiến hành:
- Cho khoảng 10 mL dung dịch CH3COONa 0,5 M vào cốc thuỷ tinh, thêm từ 1-2 giọt phenolphthalein, khuấy đều.
- Chia dung dịch thu được vào 3 ống nghiệm khác. Ống nghiệm (1) dùng để so sánh, ống nghiệm (2) đem đi ngâm vào cốc nước đá, ống nghiệm (3) đem đi ngâm vào cốc nước nóng.
Khi tăng nhiệt độ mà cân bằng chuyển dịch theo chiều giảm nhiệt độ, tức là chiều phản ứng thu nhiệt nghĩa là chiều làm giảm tác động của vật tăng nhiệt độ và ngược lại.
3.2 Yếu tố nồng độ
Nghiên cứu về ảnh hưởng của nồng độ đến sự chuyển dịch cân bằng trong phản ứng hóa học:
CH3COONa + H2O ⇌ CH3COOH + NaOH
Thí nghiệm nghiên cứu về ảnh hưởng của nồng độ đến sự chuyển dịch cân bằng trong phản ứng trên được thực hiện như sau đây:
- Cho một vài giọt phenolphthalein vào dung dịch CH,COONa, lắc đều, dung dịch có màu hồng nhạt.
- Chia dung dịch thu được vào ba ống nghiệm với thể tích gần bằng nhau. Ống nghiệm (1) dùng để so sánh, ống nghiệm (2) thêm một vài tinh thể CH3COONa, ống nghiệm (3) thêm một vài giọt dung dịch acid CH3COOH.
CH3COONa + H2O ⇌ CH3COOH + NaOH
Khi tăng nồng độ một chất bất kỳ trong phản ứng thì cân bằng hoá học sẽ bị phá vỡ và phản ứng sẽ chuyển dịch theo chiều làm giảm nồng độ của chất đó đi và ngược lại.
3.3 Yếu tố áp suất
Ảnh hưởng của áp suất tới chuyển dịch cân bằng trong phản ứng:
2NO2(g) ⇌ N2O4(g)
(màu nâu đỏ) (không màu)
Thí nghiệm nghiên cứu ảnh hưởng của áp suất đến sự chuyển dịch cân bằng trên được thực hiện như sau: Lấy một ống xi-lanh đựng khí NO2. Đẩy pit-tông xuống để làm giảm thể tích và làm tăng áp suất trong ống. Lúc này màu của khí trong xi-lanh trở nên đậm hơn. Sau một thời gian, khí trong ống lại nhạt màu hơn. Như vậy, khi chúng ta tăng áp suất, cân bằng trên sẽ chuyển dịch theo chiều làm giảm số mol khí ở trong xi-lanh.
Khi ta tăng áp suất chung của một hệ thì cân bằng sẽ chuyển dịch theo chiều làm giảm đi áp suất tức là chiều phản ứng làm giảm số mol khí và ngược lại.
Đối với loại phản ứng thuận nghịch sẽ có tổng hệ số tỉ lượng của các chất khí ở hai vế của phương trình hoá học là bằng nhau thì trạng thái cân bằng của hệ sẽ không bị chuyển dịch khi ta thay đổi áp suất chung của hệ.
Chất xúc tác: Đối với các phản ứng thuận nghịch xảy ra với tốc độ chậm thì những chất xúc tác sẽ giúp hệ phản ứng sẽ nhanh đạt tới trạng thái cân bằng. Chất xúc tác sẽ làm tăng tốc độ phản ứng thuận và phản ứng nghịch với số lần bằng nhau nên sẽ không làm chuyển dịch cân bằng phản ứng.
3.4 Nguyên lý chuyển dịch cân bằng Le Chatelier
Thông qua việc nghiên cứu về các yếu tố ảnh hưởng đến trạng thái cân bằng, nhà hoá học người Pháp có tên Le Chatelier (Lơ Sa-tơ-li-ê) đã đưa ra một nguyên lý mang tên ông như sau:
Một phản ứng thuận nghịch đang ở trong trạng thái cân bằng, khi chịu một tác động bên ngoài dẫn đến sự thay đổi nồng độ, nhiệt độ, áp suất thì cân bằng sẽ dần chuyển dịch theo chiều làm giảm đi các tác động bên ngoài đó.
Nguyên lý chuyển dịch cân bằng Le Chatelier mang một ý nghĩa rất lớn khi được vận dụng vào kỹ thuật công nghiệp hoá học. Người ta có thể ứng dụng trong thay đổi các điều kiện để chuyển dịch cân bằng theo chiều mà con người mong muốn, làm tăng hiệu suất của phản ứng hóa học.
Ví dụ: Trong công nghiệp, ammonia được tổng hợp theo phản ứng
N2(g) + 3H2(g) ⇌ 2NH3(g)
Yếu tố áp suất:
Theo phương trình hoá học của phản ứng trên, khi phản ứng xảy ra làm giảm số mol khí của hệ. Do đó, theo nguyên lý Le Chatelier, khi tăng áp suất thì cân bằng trên chuyển dịch theo chiều thuận, tức là theo chiều tạo ra nhiều ammonia hơn. Thực tế phản ứng tổng hợp ammonia thường được thực hiện ở áp suất khoảng 200 bar.
Yếu tố nhiệt độ:
Phản ứng ở trên là loại phản ứng toả nhiệt. Do đó, để cân bằng chuyển dịch về phía tạo thành ammonia, cần thực hiện phản ứng ở nhiệt độ thấp. Tuy nhiên, ở nhiệt độ thấp, tốc độ của phản ứng này rất chậm. Vì vậy thực tế, ammonia được tổng hợp ở nhiệt độ khoảng 450°C.
Ngoài ra, để tăng tốc độ phản ứng, người ta sử dụng chất xúc tác là bột Fe.

4. Câu hỏi trắc nghiệm liên quan đến khái niệm về cân bằng hóa học
Câu 1: Cho cân bằng hóa học: 2SO2 (g) + O2 (g) ⇌ 2SO3 (g)Phản ứng theo chiều thuận là phản ứng tỏa nhiệt. Phát biểu nào dưới đây là đúng?
A. Cân bằng sẽ chuyển dịch theo chiều thuận khi tăng nhiệt độ của phản ứng
B. Cân bằng sẽ chuyển dịch theo chiều nghịch khi giảm đi nồng độ O2
C. Cân bằng sẽ chuyển dịch theo chiều thuận khi giảm áp suất hệ của phản ứng
D. Cân bằng sẽ chuyển dịch theo chiều nghịch khi giảm nồng độ của SO3
Câu 2: Cho cân bằng hóa học: N2 (g) + 3H2 (g) ⇌ 2NH3 (g) Phản ứng theo chiều thuận là phản ứng tỏa nhiệt. Cân bằng hóa học sẽ không bị chuyển dịch khi
A. thay đổi đi áp suất của hệ
B. thay đổi đi nồng độ N2
C. thay đổi nhiệt độ
D. thêm chất xúc tác là Fe
Câu 3: Trong một bình kín có cân bằng hóa học sau: 2NO2 (g) ⇌ N2O4 (g) Tỉ khối hơi của hỗn hợp khí ở trong bình so với H2 ở nhiệt độ T1 là bằng 27,6 và ở nhiệt độ T2 là bằng 34,5. Biết T1 > T2. Phát biểu nào sau đây về chuyển dịch cân bằng trên là chính xác?
A. Phản ứng theo chiều thuận là phản ứng tỏa nhiệt.
B. Khi tăng nhiệt độ của phản ứng, áp suất chung của hệ cân bằng sẽ giảm.
C. Khi giảm nhiệt độ của phản ứng, áp suất chung của hệ cân bằng sẽ tăng.
D. Phản ứng theo chiều nghịch là phản ứng tỏa nhiệt.
Câu 4: Cho cân bằng hóa học sau: 2SO2 (g) + O2 (g) ⇌ 2SO3 (g) ; ΔH < 0 Cho các biện pháp: (1) Tăng nhiệt độ; (2) Tăng áp suất chung của hệ phản ứng; (3) Hạ nhiệt độ; (4) Dùng thêm chất xúc tác là S2O5; (5) Giảm nồng độ SO3; (6) Giảm áp suất chung trong hệ phản ứng. Trong các biện pháp nói trên, những biện pháp nào sẽ làm cân bằng chuyển dịch theo chiều phản ứng thuận?
A. (1), (2), (4), (5)
B. (2), (3), (5)
C. (2), (3), (4), (6)
D. (1), (2), (5)
Câu 5: Cho các cân bằng: (1) H2 (g) + I2 (g) ⇆ 2HI (g) (2) 2NO (g) + O2 (g) ⇆ 2NO2 (g) (3) CO (g) + Cl2(g) ⇆ COCl2 (g) (4) CaCO3 (sr) ⇆ CaO (s) + CO2 (g) (5) 3Fe (rs) + 4H2O (g) ⇆ Fe3O4 (s) + 4H2 (g) Các cân bằng sẽ chuyển dịch theo chiều phản ứng thuận khi tăng áp suất lên là:
A. (1), (4).
B. (1), (5).
C. (2), (3), (5).
D. (2), (3).
Câu 6: Phản ứng: 2SO2 + O2 ⇆ 2SO3 ΔH < 0. Khi giảm nhiệt độ của phản ứng và khi giảm áp suất thì cân bằng của phản ứng trên sẽ chuyển dịch tương ứng là:
A. Thuận và thuận.
B. Thuận và nghịch.
C. Nghịch và nghịch.
D. Nghịch và thuận.
Câu 7: Phản ứng thuận nghịch là được gọi là phản ứng
A. trong cùng một điều kiện, phản ứng sẽ xảy ra theo hai chiều trái ngược nhau.
B. có phương trình hoá học được biểu diễn bởi một mũi tên một chiều.
C. chỉ xảy ra theo một chiều nhất định không đổi.
D. chỉ xảy ra giữa hai chất là khí.
Câu 8: Khi một hệ ở trạng thái cân bằng thì trạng thái đó là
A. cân bằng tĩnh.
B. cân bằng động.
C. cân bằng bền.
D. cân bằng không bền.
Câu 9: Cho cân bằng hoá học: PCl5 (g) ⇄ PCl3 (g) + Cl2 (g); ΔH > 0. Cân bằng chuyển dịch theo chiều phản ứng thuận khi
A. thêm PCl3 vào hệ phản ứng.
B. tăng áp suất của hệ phản ứng.
C. tăng nhiệt độ của hệ phản ứng.
D. thêm Cl2 vào hệ phản ứng.
Câu 10: H2 (g) + I2 (g) ⇌ 2HI (g); ΔH > 0 Cân bằng sẽ không bị chuyển dịch khi
A. tăng nhiệt độ của hệ
B. giảm nồng độ HI
C. tăng nồng độ H2
D. giảm áp suất chung của hệ.
Đáp án:
1 2 3 4 5 6 7 8 9 10 B D A B D B A B C DTrên đây, VUIHOC đã cung cấp cho các bạn kiến thức về khái niệm về cân bằng hóa học trong chương trình Hóa 11. Ngoài ra, để học nhiều hơn các kiến thức các môn học của THPT thì các em hãy truy cập vuihoc.vn hoặc đăng ký khoá học với các thầy cô VUIHOC ngay bây giờ nhé!
Link nội dung: https://ausp.edu.vn/khai-niem-ve-can-bang-hoa-hoc-hoa-11-moi-a13268.html