
Nồng độ mol là gì? Cách tính và một số bài tập vận dụng có lời giải
Nồng độ mol là gì, gồm những dạng bài tập quan trọng, thường gặp trong chương trình hóa học trung học. Vậy nó được tính như thế nào? Hãy cùng VietChem tìm hiểu chi tiết trong bài viết sau và tham khảo một số bài tập vận dụng để hiểu rõ hơn nhé.
Nồng độ mol là gì?
Nồng độ mol biểu thị cho số mol của một chất tan trong một lít dụng dịch, nó được kí hiệu là M
Ví dụ: Trong 4 lít dung dịch chứa 2 mol hạt tan tạo nên dung dịch 0,5 M hay còn gọi là 0,5 phân tử gam.
Ngày nay mol được dùng rộng rãi trong hóa học để thể hiện lượng chất phản ứng cùng sản phẩm của các phản ứng học. Ngoài ra, nó còn được sử dụng để biểu thị số lượng nguyên tử, các thực thể khác nhau trong một mẫu nhất định của một chất hay ion.

Nồng độ mol là gì
>>>XEM THÊM:Chất thải nguy hại - Phân loại, mã màu quy định và cách xử lý
Công thức tính nồng độ mol
- Ta có công thức:
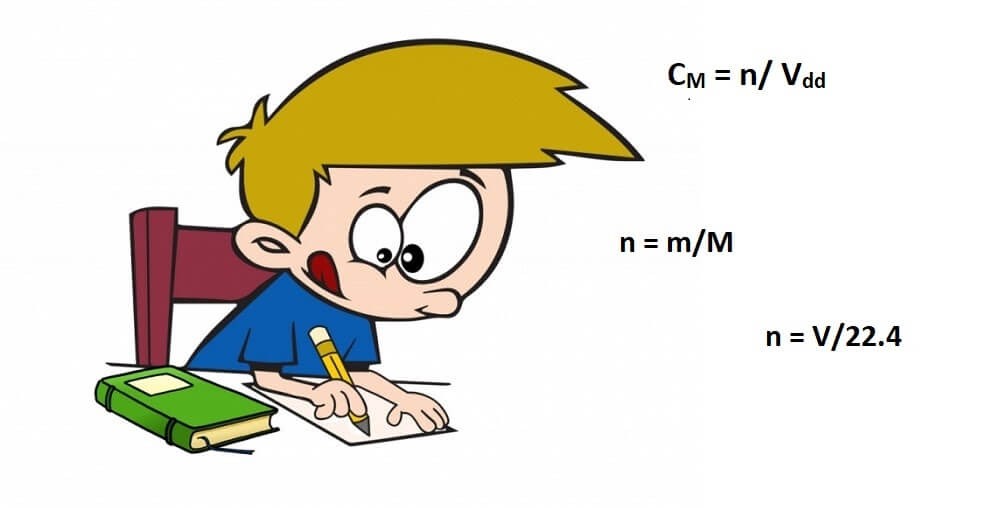
CM = n/ Vdd
Trong đó:
- CM là nồng độ mol
- n là số mol chất tan
- Vdd là thể tích dung dịch (đơn vị tính: lít)
Công thức tính số mol đơn giản
1. Cách tính số mol qua thể tích
n = V/22.4
Trong đó:
- n là số mol chất khí tại điều kiện tiêu chuẩn (đktc) với đơn vị tính: mol
- V: thể tích của chất khí ở đktc (tính bằng lít)
2. Tính số mol thông qua khối lượng
n = m/M
Trong đó:
- n là số mol, có đơn vị tính là mol
- m là khối lượng được tính bằng gam
- M là khối lượng mol chất, tính bằng g/mol
3. Một số cách tính khác
Điều kiện
Công thức
Chú thích
Đơn vị tính
Khi có nồng độ mol/lít
n = CM.V
- n: số mol chất
mol
- CM: nồng độ mol
Mol/lit
- V: thể tích dung dịch
lit
Khi biết số nguyên tử hay phân tử
n = A/N
- A: số nguyên tử hay phân tử
Nguyên tử hoặc phân tử
- Số Avogadro (số đơn vị trong bất cứ một mol chất nào và có giá trị bằng 6.1023)
Tính số mol khí tại điều kiện thường
n = P.V/R.T
- P: Áp suất
1 atm = 760mmHg
- V: thể tích khí
Lít
- R: hằng số
0,082 (hoặc 62400)
- T: nhiệt độ tính theo độ Kelvin (K)
K = 273 + độ C

Có rất nhiều cách tính số mol
Tham khảo một số bài tập tính nồng độ mol
Một số bài tập tham khảo về cách tính nồng độ mol:
Bài tập 1: Trong 400ml dung dịch có hòa tan 32 gam chất NaOH. Hãy tính nồng độ mol của dung dịch
Lời giải:
- Đổi 400 ml = 0,4 lít
- nNaOH = 36/40 = 0,9 mol
- Theo công thức tính CM ta có:
- Cdd = n/V = 0,9/0,4 = 2,25 (M)
Bài tập 2: Tính CM của 0,5 mol MgCl2 có trong 1,5 lít dung dịch
Lời giải:
- Áp dụng vào công thức tính CM ta có:
CM = 0,51 x 5 = 0,33 (mol)
Bài tập 3: Tính nồng độ mol của một dung dịch chứa 0,5 mol NaCl trong 5 lít dung dịch.
Lời giải:
CM = 0,5/5 = 0,1 (mol)
Bài tập 4: Hãy tính nồng độ mol của dung dịch khi tiến hành hòa tan 15,8g KMnO4 trong 7,2 lít nước.
Lời giải:
- Số mol của chất nKMnO4 là:
nKMnO4 = 15,8/ 158 = 0,1 (mol)
- Vậy CM sẽ bằng: 0,1/ 7,2 = 0,0139
Bài tập 5: Tiến hành cho 6,5 gam kẽm phản ứng vừa đủ với 100 ml dung dịch axit chohidric (HCl). Hãy:
- a) Tính thể tích của H2 thu được ở điều kiện tiêu chuẩn
- b) Tính nồng độ mol của dung dịch HCl đã sử dụng
Lời giải:
- Theo bài ra ta có:
nZn = 6,5/ 65 = 0,1 mol
- Phương trình phản ứng:
Zn + 2HCl → ZnCl2 + H2
- nZn = nZnCl2 = 0,1 mol
- nHCl = 2nZn = 0,2 mol
- a) VH2 = 0,1 x 22,4 = 2,24 (lít)
- b) CddHCl = 0,2/ 0,1 = 2 (M)
Trên đây, VietChem đã giới thiệu cho bạn đọc chi tiết về nồng độ mol là gì cũng như cách tính và một số bài tập vận dụng cơ bản. Mong rằng, qua bài viết đã giúp bạn hiểu rõ hơn các vấn đề này và có thể áp dụng trong học tập hay công việc. Truy cập vietchem.com.vn thường xuyên để đón đọc nhiều bài viết hữu ích khác.
Link nội dung: https://ausp.edu.vn/index.php/nong-do-mol-la-gi-cach-tinh-va-mot-so-bai-tap-van-dung-co-loi-giai-a24208.html