
Zn hóa trị mấy? Các tính chất và ứng dụng của Zn
Giới thiệu về Zn (Kẽm)
Kẽm (Zn) là một nguyên tố mà có lẽ bạn tiếp xúc mỗi ngày. Nó có mặt khắp nơi trong cuộc sống, từ những chiếc hàng rào chống rỉ sét cho đến việc giữ cho hệ miễn dịch của chúng ta hoạt động tốt.
Khái niệm Zn
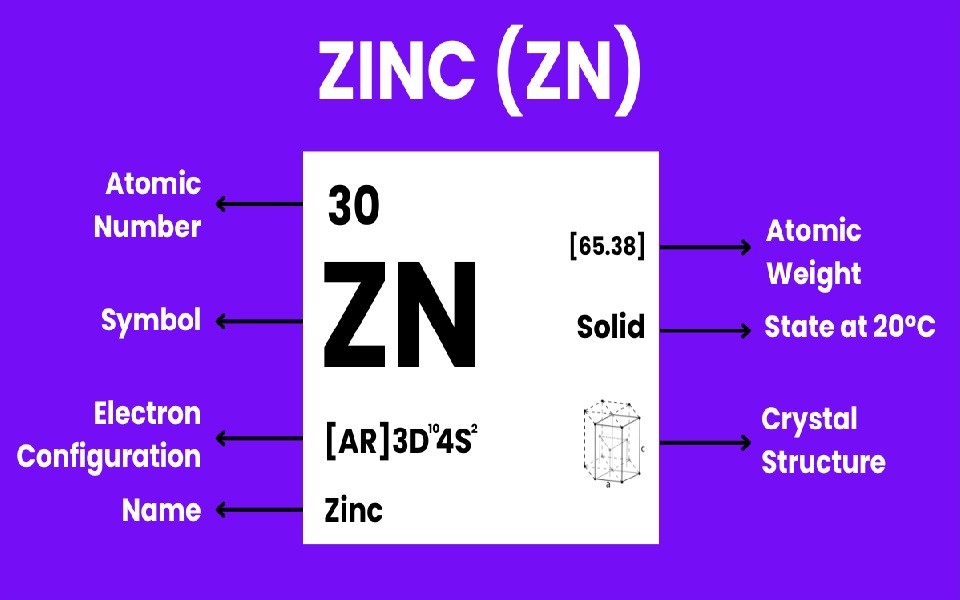
Zn hay còn gọi là kẽm, là một nguyên tố kim loại lưỡng tính thuộc kim loại chuyển tiếp (transition metal). Đây là nguyên tố có mặt khắp mọi nơi trong cuộc sống của chúng ta, từ pin, đồ điện tử đến kem chống nắng hay thậm chí là trong cơ thể bạn. Nó là một nguyên tố hóa học với ký hiệu là Zn và số hiệu nguyên tử là 30. Zn khá phổ biến và đóng vai trò cực kỳ quan trọng trong nhiều ngành công nghiệp và sinh học.
Vị trí trong bảng tuần hoàn
Nhìn vào bảng tuần hoàn, nguyên tố Zn nằm trong nhóm 12 (IIB), chu kỳ 4. Điều này có nghĩa là nó chia sẻ một số tính chất chung với các nguyên tố khác trong nhóm kim loại chuyển tiếp, nhưng vẫn có những nét độc đáo riêng. Nếu bạn nhìn vào bảng tuần hoàn, nguyên tố Zn nằm ngay sau đồng (Cu) và trước gallium (Ga).
Tính chất vật lý
Màu sắc và trạng thái
Nếu bạn đã từng nhìn thấy zinc, bạn sẽ nhận ra nó có màu trắng xanh ánh bạc. Không quá mềm, không quá cứng, Zn ở nhiệt độ phòng là một kim loại rắn, nhưng nó lại khá dễ uốn khi được làm nóng. Zn có thể biến dạng một chút mà không vỡ nứt, tuy nhiên khi nhiệt độ hạ xuống, zinc trở nên giòn, có thể dễ dàng bị bẻ gãy như một miếng bánh khô.
Khối lượng riêng
Kẽm có khối lượng riêng là 7,14 g/cm³, không nặng như sắt nhưng cũng chẳng nhẹ như nhôm. Điều này làm cho nó trở thành một vật liệu lý tưởng trong nhiều ứng dụng, từ xây dựng đến công nghệ. Đơn giản, nó đủ nặng để bảo vệ, nhưng không quá cồng kềnh.
Nhiệt độ nóng chảy và nhiệt độ sôi
Zn là một trong những kim loại dễ nóng chảy hơn so với nhiều kim loại khác. Nhiệt độ nóng chảy của kẽm chỉ vào khoảng 419,5°C. Khi đạt nhiệt độ này, Zn từ trạng thái rắn chuyển sang lỏng.
Nhưng nếu bạn muốn biến Zn thành hơi nước, thì cần đẩy nhiệt độ lên cao hơn nhiều. Nhiệt độ sôi của kẽm là 907°C. Khi đó, Zn không chỉ tan chảy, mà bốc hơi thành khí, biến mất trong không trung.
Tính dẫn điện và dẫn nhiệt
Một điều đáng chú ý về Zn là khả năng dẫn điện và dẫn nhiệt của nó. Zn không chỉ truyền nhiệt tốt mà còn truyền điện rất ổn định. Tuy nhiên, nó không thuộc hàng ngũ như bạc hay đồng, nhưng vẫn đóng vai trò quan trọng trong các ứng dụng cần sự cân bằng giữa giá trị và hiệu suất.
Cấu trúc tinh thể
Zn có cấu trúc tinh thể lục giác, một hình dạng khá ổn định và bền vững. Các nguyên tử Zn xếp thành những tầng lục giác chồng lên nhau, tạo nên một hình khối vững chắc nhưng lại linh hoạt, giúp Zn duy trì được độ bền khi chịu tác động.
Tính chất hóa học của Zn
Trước hết, Zn là một kim loại có khả năng phản ứng rất linh hoạt. Đặc biệt, nó dễ dàng cho đi hai electron ở lớp vỏ ngoài cùng của mình để trở thành ion Zn²⁺.
Phản ứng với axit
Một trong những phản ứng đặc trưng của Zn là với các loại axit. Zn có thể phản ứng mạnh với axit loãng như axit hydrochloric (HCl), tạo ra khí hydro và muối kẽm clorua (ZnCl₂).
Phương trình phản ứng:
Phản ứng với oxi
Khi tiếp xúc với không khí ở nhiệt độ cao, Zn sẽ bị oxi hóa, tạo thành oxit kẽm (ZnO). Lớp oxit này như một chiếc áo giáp bảo vệ zinc khỏi bị ăn mòn thêm. Nhưng điều thú vị là ZnO không chỉ bảo vệ, nó còn rất hữu ích trong đời sống, từ mỹ phẩm đến chất phụ gia thực phẩm.
Phương trình phản ứng:
Phản ứng với kiềm
Zinc có khả năng phản ứng cả với các dung dịch kiềm mạnh, như natri hydroxide (NaOH). Khi nguyên tố Zn gặp NaOH, một phản ứng xảy ra, tạo ra hợp chất natri kẽmát (Na₂ZnO₂) và giải phóng khí hydro. Đây là một phản ứng khá đặc biệt, vì không phải kim loại nào cũng có thể phản ứng với kiềm theo cách này.
Phương trình phản ứng:
Vai trò của Zn trong các phản ứng khử
Nguyên tố Zn không chỉ cho, mà đôi khi nó còn là hỗ trợ trong các phản ứng khử, giúp lấy đi oxi từ các hợp chất khác. Nhờ tính chất này, zinc thường được sử dụng trong quá trình khử các oxit kim loại để tạo ra kim loại nguyên chất.
Ví dụ:
Ở đây, nguyên tố Zn khử oxit đồng (CuO), giúp tách đồng ra khỏi hợp chất.
Zn hóa trị mấy?
Chúng ta đã biết kẽm (Zn) là gì và nó nằm ở đâu trong bảng tuần hoàn, giờ hãy đào sâu vào một khía cạnh quan trọng khác: hóa trị của nó. Tại sao Zn lại có hóa trị 2 và điều này có ý nghĩa gì trong thế giới hóa học?
Hóa trị
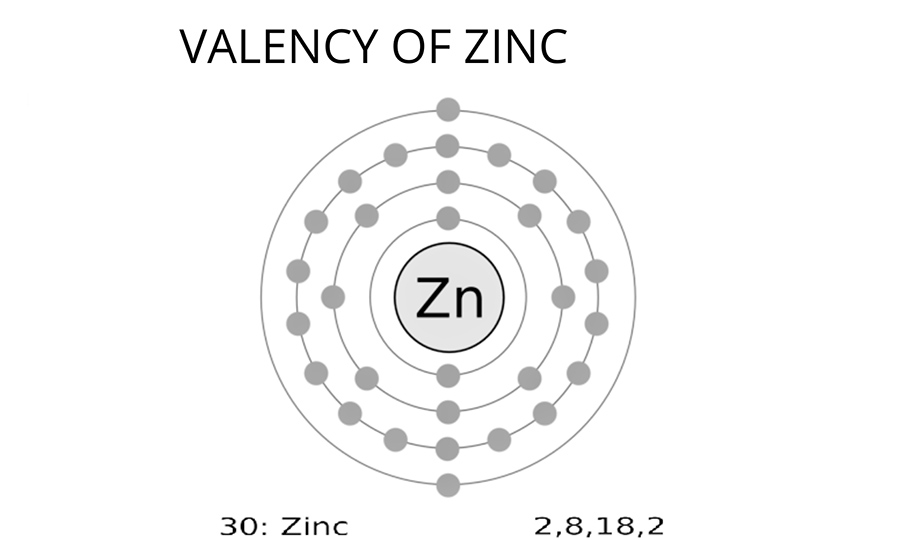
Trong các phản ứng hóa học, Zn thường xuất hiện với hóa trị 2. Điều này có nghĩa là nó thường mất đi 2 electron để tạo thành ion Zn²⁺. Đây là hóa trị phổ biến nhất của Zn, và nếu bạn nghĩ về mọi hợp chất có liên quan đến Zn, đa phần chúng đều chứa ion Zn²⁺.
Cấu hình electron Zn
Nguyên tử Zn có cấu hình electron là: 1s² 2s² 2p⁶ 3s² 3p⁶ 3d¹⁰ 4s². Bạn có thể thấy, lớp vỏ ngoài cùng của Zn là 4s², với 2 electron. Chính hai electron này là những thành phần trong các phản ứng, tạo ra ion Zn²⁺. Lớp 3d phía dưới thì lại ổn định và không tham gia vào việc mất electron.
Nhìn vào cấu hình electron của Zn, có thể thấy rằng sau khi mất đi 2 electron 4s², Zn trở nên ổn định hơn rất nhiều, vì lúc này, cấu hình electron của nó giống như của khí argon, một trong những khí hiếm không phản ứng. Chính vì vậy, Zn hầu như luôn có hóa trị 2, bởi đây là con đường dễ dàng nhất để nó đạt được trạng thái ổn định.
Ứng dụng của Zn
Zn có nhiều vai trò trong cuộc sống, từ ngành công nghiệp, y tế cho đến các sản phẩm mà chúng ta sử dụng hàng ngày.

Trong công nghiệp
Zn không chỉ là một kim loại riêng lẻ mà còn là một phần không thể thiếu trong nhiều quy trình sản xuất.
- Hợp kim: Kẽm thường được kết hợp với các kim loại khác để tạo ra hợp kim. Hợp kim nổi bật nhất chính là đồng thau (brass), được tạo từ kẽm và đồng, có độ bền cao và khả năng chống ăn mòn tốt. Kẽm cũng có mặt trong nhiều thiết bị cơ khí, từ bộ phận nhỏ nhất đến các kết cấu lớn hơn.
- Mạ kẽm: Một trong những ứng dụng nổi bật của kẽm là quá trình mạ kẽm. Khi bạn nhìn thấy các vật liệu kim loại ngoài trời như hàng rào, cột điện, thậm chí là vỏ xe hơi, đó là thành quả của việc mạ kẽm. Lớp mạ này giúp kim loại không bị ăn mòn bởi thời tiết khắc nghiệt, đặc biệt là mưa axit hay độ ẩm cao. Kẽm tạo bảo vệ cho các vật liệu, đảm bảo tuổi thọ lâu dài cho chúng.
- Pin: kẽm còn là nguồn năng lượng trong các loại pin. Pin kẽm-carbon và pin kẽm-không khí là những ví dụ điển hình mà bạn gặp trong cuộc sống hàng ngày, từ các thiết bị điện tử cho đến máy trợ thính.
Trong y tế
Kẽm không chỉ là một nguyên tố kỹ thuật, mà còn là một nguyên tố vi lượng thiết yếu cho sức khỏe.
- Vi chất dinh dưỡng: Nó tham gia vào hàng loạt các quá trình sinh học, từ việc hỗ trợ hệ miễn dịch đến quá trình tăng trưởng và phục hồi tế bào. Thiếu kẽm có thể dẫn đến suy giảm hệ miễn dịch, làm chậm lành vết thương, và ảnh hưởng đến sự phát triển, đặc biệt là ở trẻ em.
- Hỗ trợ sức khỏe: Kẽm còn có vai trò quan trọng trong việc duy trì sức khỏe tổng thể, đặc biệt là đối với làn da, tóc, và móng tay. Nó giúp cơ thể tổng hợp protein và DNA, đảm bảo rằng các mô cơ thể luôn khỏe mạnh và hoạt động hiệu quả.
Trong đời sống hàng ngày
- Sản phẩm tiêu dùng: Kẽm hiện diện trong rất nhiều sản phẩm tiêu dùng mà bạn có thể không ngờ tới. Từ kem chống nắng (với oxit kẽm là thành phần chính bảo vệ da khỏi tia UV) đến mỹ phẩm và các sản phẩm chăm sóc cá nhân.
- Ứng dụng khác: Ngoài ra, Zn còn được sử dụng trong sơn, giúp tạo ra màu sắc bền lâu và chống thấm nước. Zn cũng có vai trò là chất xúc tác trong nhiều phản ứng hóa học, từ sản xuất phân bón đến xử lý hóa chất.
Sản xuất và điều chế Zn
Hành trình từ quặng kẽm đến kim loại nguyên chất là cả một câu chuyện thú vị.

Khai thác từ quặng
Kẽm không xuất hiện ở tự nhiên trong lòng đất dưới dạng nguyên chất, mà nó thường gắn liền với các khoáng chất khác, chủ yếu là trong các loại quặng như sphalerit (ZnS). Quặng kẽm nằm sâu dưới lòng đất, khi khai thác và xử lý đúng cách thì chúng ta mới lấy được kim loại kẽm bên trong. Các mỏ kẽm lớn thường tập trung ở các quốc gia như Trung Quốc, Úc, Peru và Hoa Kỳ.
Để khai thác Zn, các công ty khai khoáng sẽ phải đào sâu xuống lòng đất hoặc thậm chí khai thác từ các mỏ lộ thiên. Quá trình này giống như tìm vàng, họ thu thập những khối quặng chứa Zn.
Quá trình điều chế
Sau khi có được quặng, hành trình điều chế mới thực sự bắt đầu.
- Nghiền và tuyển quặng: Đầu tiên, quặng được nghiền nhỏ để tách các khoáng chất kẽm ra khỏi các tạp chất khác. Quá trình này giống như việc lọc sạch tạp chất để lấy phần kẽm quý giá ra khỏi quặng. Sau đó, các nhà máy sử dụng các phương pháp như tuyển nổi để tập trung kẽm vào dạng cô đặc hơn.
- Nung: Sau khi có được quặng cô đặc, nó được đưa vào lò nung để chuyển đổi khoáng chất kẽm từ dạng sunfua (ZnS) thành dạng oxit (ZnO). Đây là bước quan trọng để chuẩn bị cho các công đoạn tiếp theo, làm nóng để chuyển đổi chất liệu thô thành dạng có thể sử dụng.
- Khử oxit kẽm: Đến đây, kẽm vẫn chưa phải là kim loại nguyên chất. Để tách kẽm ra khỏi hợp chất oxit, người ta sử dụng phương pháp khử bằng than cốc (coke). Quá trình này diễn ra trong các lò lớn ở nhiệt độ cao, nơi oxit kẽm được biến đổi thành kim loại kẽm và khí CO₂ được giải phóng.
- Chưng cất và tinh chế: Cuối cùng, kẽm thu được từ quá trình khử vẫn còn chứa tạp chất. Vì vậy, nó sẽ trải qua quá trình chưng cất để làm sạch và tinh chế, đảm bảo rằng sản phẩm cuối cùng là kẽm nguyên chất, sẵn sàng cho các ứng dụng trong công nghiệp.
Kết luận
Kẽm (Zn) - một nguyên tố nhỏ nhưng lại đóng vai trò to lớn trong cuộc sống, từ công nghiệp đến y tế và đời sống hàng ngày. Dù không nổi bật nhiều so với các kim loại phổ biến khác nhưng Zn chính là nền tảng vững chắc giúp mọi thứ hoạt động hiệu quả hơn. Với các thông tin mà Học là Giỏi vừa giải đáp như Zn hóa trị mấy? tính chất và ứng dụng của nó sẽ giúp bạn nắm rõ kiến thức và có cái nhìn sâu hơn về nguyên tố này.
Link nội dung: https://ausp.edu.vn/index.php/zn-hoa-tri-may-cac-tinh-chat-va-ung-dung-cua-zn-a19800.html